2023届贵阳一中高考适应性月考(二)2英语试题答案

2023届贵阳一中高考适应性月考(二)2英语试题答案,目前我们已经整理了2023届贵阳一中高考适应性月考(二)2英语试题答案的各科答案和试卷,更多试卷答案请关注本答案网。

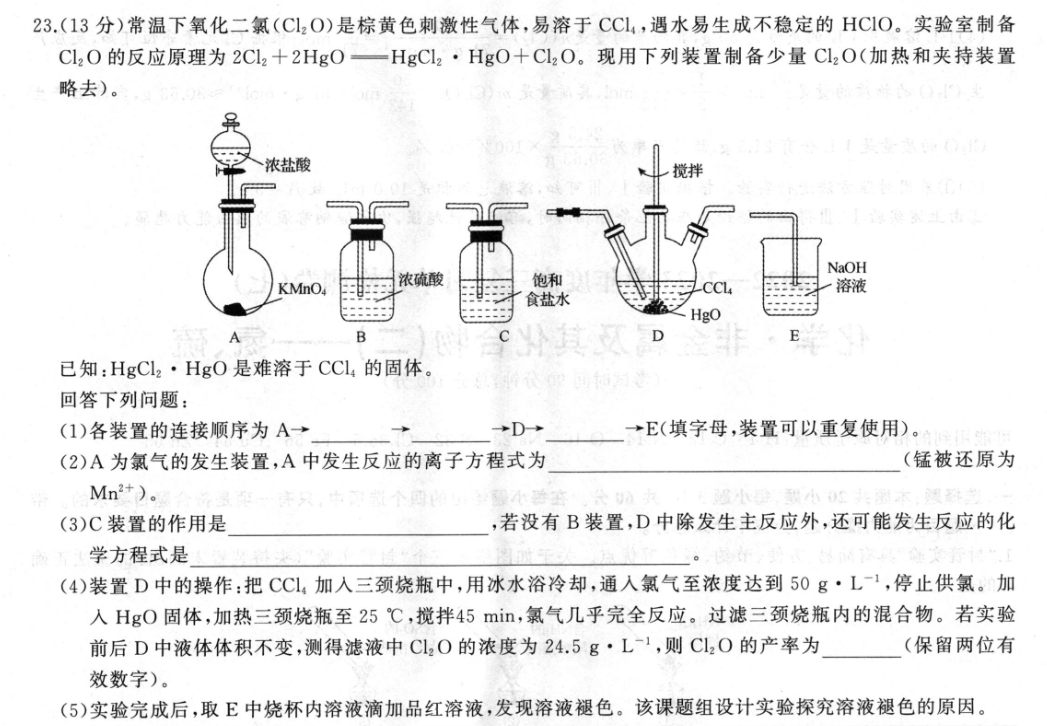
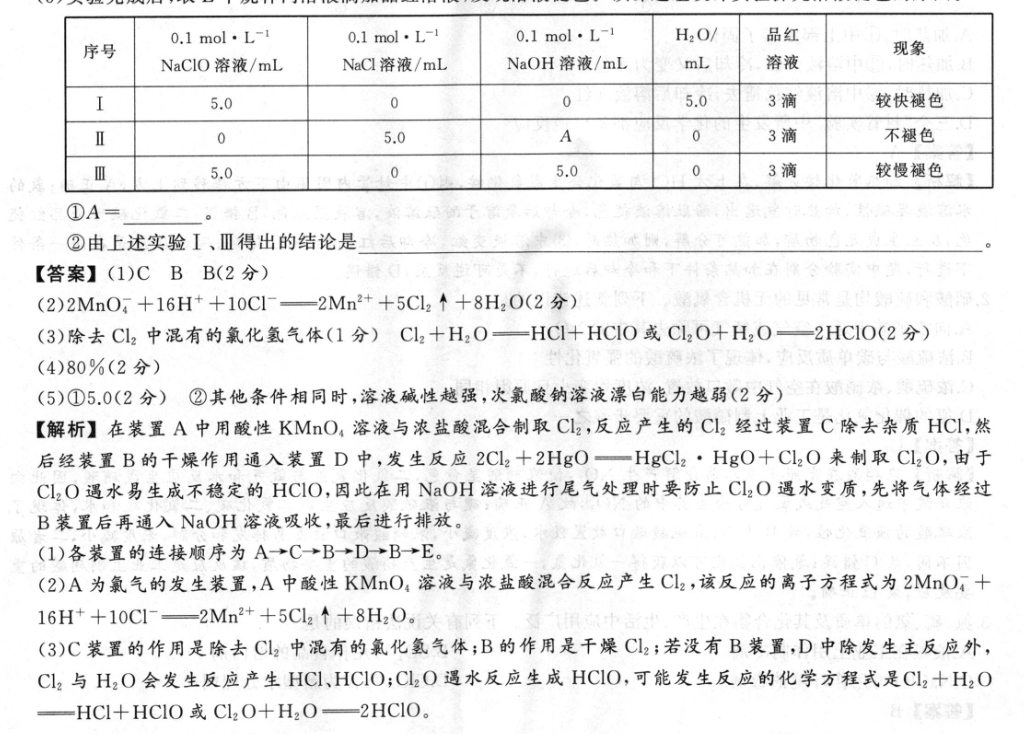

23.(13分)常温下氧化二氯(C12O)是棕黄色刺激性气体,易溶于CC14,遇水易生成不稳定的HC1O。实验室制备CL2O的反应原理为2C12+2HgO一HgCl2·HgO+Cl2O。现用下列装置制备少量Cl2O(加热和夹持装置略去)。浓盐酸NaOHKMnO浓硫酸饱和溶液食盐水AB已知:HgCl2·HgO是难溶于CCL的固体。回答下列问题:(1)各装置的连接顺序为A→→D→→E(填字母,装置可以重复使用)。(2)A为氯气的发生装置,A中发生反应的离子方程式为(锰被还原为Mn2+).个(3)C装置的作用是,若没有B装置,D中除发生主反应外,还可能发生反应的化学方程式是(4)装置D中的操作:把CCl4加入三颈烧瓶中,用冰水浴冷却,通入氯气至浓度达到50g·L1,停止供氯。加入HgO固体,加热三颈烧瓶至25℃,搅拌45mi,氯气几乎完全反应。过滤三颈烧瓶内的混合物。若实验前后D中液体体积不变,测得滤液中C120的浓度为24.5g·L-1,则CL20的产率为(保留两位有效数字)。(5)实验完成后,取E中烧杯内溶液滴加品红溶液,发现溶液褪色。该课题组设计实验探究溶液褪色的原因。0.1mol·L-10.1mol·L-10.1mol·L-1H2O/品红序号现象NaCIO溶液/mLNaC溶液/mLNaOH溶液/mLmL溶液I5.0005.03滴较快褪色Ⅱ05.0A03滴不褪色Ⅲ5.005.003滴较慢褪色论通①A=②由上述实验I、Ⅲ得出的结论是【答案】(1)CBB(2分)(2)2MnO4+16H++10CI—2Mn2++5Cl2↑+8H2O(2分)(3)除去Cl2中混有的氯化氢气体(1分)Cl2+H2O—HCI+HCIO或Cl2O+H2O—2HC1O(2分)(4)80%(2分)(5)①5.0(2分)②其他条件相同时,溶液碱性越强,次氯酸钠溶液漂白能力越弱(2分)空,记【解析】在装置A中用酸性KMO,溶液与浓盐酸混合制取Cl2,反应产生的CL2经过装置C除去杂质HCI,然后经装置B的千燥作用通入装置D中,发生反应2Cl2+2HgO一HgCl2·HgO十C12O来制取CI2O,由于Cl2O遇水易生成不稳定的HCIO,因此在用NaOH溶液进行尾气处理时要防止Cl2O遇水变质,先将气体经过B装置后再通入NaOH溶液吸收,最后进行排放。(1)各装置的连接顺序为A→C→B→D→B→E。(2)A为氯气的发生装置,A中酸性KMnO4溶液与浓盐酸混合反应产生Cl2,该反应的离子方程式为2MnO,十16H++10C1--2Mn2++5Cl2↑+8H2O.(3)C装置的作用是除去C2中混有的氟化氢气体;B的作用是千燥C2;若没有B装置,D中除发生主反应外,Cl2与H2O会发生反应产生HCl,HCIO;C2O遇水反应生成HCIO,可能发生反应的化学方程式是C2+H2OHCI+HCIO或Cl2O+H2O-2HClO。(4)1L溶液中C,的质量是50g,其物质的量是n(C,)-,50g5071g·mol17mol;根据CI元素守恒可知,反应产生CL,0的畅质的量是职0lX号050mol,其质量是m(Cl2O)50142molX87g·mol1≈30.63g,实际上产生Cl20的质量是1L含有24.5g,故其产率为24.5g×100%≈80%。0.63g(5)①采用对照方法进行实验。根据实验I、Ⅲ可知,溶液总体积是10.0mL,故A=5.0。②由上述实验I、Ⅲ得出的结论是在其他条件相同时,溶液碱性越强,次氯酸钠溶液的漂白能力越弱。
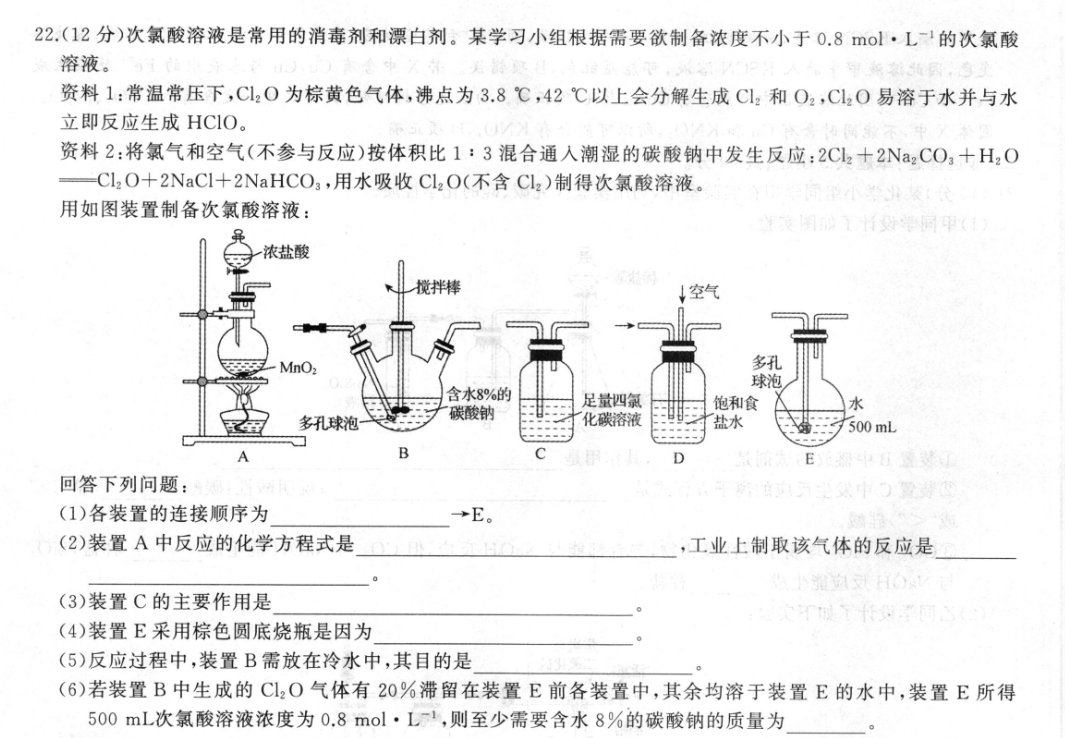

22.(12分)次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol·L1的次氯酸溶液。资料1:常温常压下,C2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成C12和O2,C12O易溶于水并与水立即反应生成HCIO。资料2:将氯气和空气(不参与反应)按体积比1:3混合通人潮湿的碳酸钠中发生反应:2Cl2+2Na2CO3十H2OCl2O+2NaCI+2 NaHCO3,用水吸收C2O(不含Cl2)制得次氯酸溶液。用如图装置制备次氯酸溶液:图沙行好学同甲(浓盐酸搅拌棒↓空气MnO多孔球泡含水8%的足量四氯饱和食碳酸钠水多孔球泡化碳溶液盐水500mLBDE回答下列问题:(1)各装置的连接顺序为→E。(2)装置A中反应的化学方程式是,工业上制取该气体的反应是(3)装置C的主要作用是(4)装置E采用棕色圆底烧瓶是因为(5)反应过程中,装置B需放在冷水中,其目的是(6)若装置B中生成的C2O气体有20%滞留在装置E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol·L,则至少需要含水8%的碳酸钠的质量为【答案】(1)A→DB→C(2分)(2)MnO2+4HCI(浓)△MnCl2+Cl2个+2H2O(2分)2H,0+2NaC电解2NaOH+Cl,↑+H,(2分)(3)除去Cl2O中的Cl2(1分)(4)棕色圆底烧瓶可以避光,防止反应生成的HCIO见光分解(2分)(5)防止反应放热后温度过高导致C12O分解(1分)(6)57.6g(2分)【解析】A装置是实验室制取氯气的装置,制得的氯气中含有HCI杂质,用饱和食盐水除掉HC1杂质,再将氯气通入碳酸钠溶液中反应生成C2O,C12O气体中含有氯气,将混合气体通入四氯化碳中吸收氯气,再通入水中反应生成次氯酸。(1)根据分析得到各装置的连接顺序为A→D→B→C→E。年①于)案含(2)装置A是实验室制取氣气的反应,其反应的化学方程式是MnO,+4HCI(浓)△MnCl2+CL2个+2H,O;工业上利用电解饱和食盐水制取该气体的反应是2H,0+2NaC1电解2NaOH+C,个十H,↑。(3)由于Cl2O中含有氯气杂质,在C12O通入水之前要将氯气除掉,因此装置C的主要作用是除去Cl2O中的Cl2。7液豫(4)次氯酸见光会分解生成盐酸和氧气,因此装置E采用棕色圆底烧瓶是因为棕色圆底烧瓶可以避光,防止反应生成的HCIO见光分解。(5)C12O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成C2和O2,因此反应过程中,装置B需放在冷水中,其目的是防止反应放热后温度过高导致C2O分解。(6)若装置B中生成的C2O气体有20%滞留在装置E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol·L1,即物质的量为0.4mol,需要的Cl20气体物质的量为0.2mol,则共产生Cl2O气体为0.25mol,根据方程式2Cl2十2Na2CO3+H2O-Cl2O+2NaC1+2 NaHCO3知,需要碳酸钠的物质的量为0.5mol,则至少需要碳酸钠的质量为0.5mol×106g·mol-1=53g,含水8%的碳酸钠的质量为53g1-8%≈57.6g。





