九师联盟·2021~2022学年高二上学期九校联盟期中考试化学答案

九师联盟·2021~2022学年高二上学期九校联盟期中考试化学答案,目前我们趣对答案已经整理了九师联盟·2021~2022学年高二上学期九校联盟期中考试化学答案的各科答案和试卷,更多试卷答案请关注本趣对答案。



2.(1)c(1分)d(1分(2)S>P>Si(1分)P>S>Si(1分)(3)sp2(1分)化合物A与水分子间存在氢键(1分)BCD(2分)(4)①6(1分)②、238×10=(2分)顶点(1分【解析】(1)电子从激发态到基态会释放能量形成发射光谱,因此用光谱仪可捕捉到发射光谱的是1s2s2p;未成对电子最多的是1s2s2p3。(2)非金属性越强,电负性越大,非金属性Si


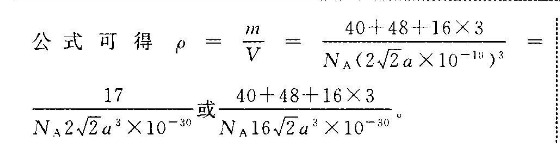
4(1)国k1分)第四周期第Ⅷ族(1分)<(1分)Fe失去第三个电子后价电子变为3d,是半充满结构较稳定,N失去三个电子后价电子变为3d,较容易失去第四个电子,所以失去第四个电子所需能量Ni小于Fe(2分)(2)(SiO1)10-(2分)(3)①0.315(1分)12(1分)② Catic3(2分)N422a3X10m(或40+48+16×3(2分)17NA16√2a3×10-0)【解析】(1)基态Cr的核外有24个电子,所以价电子排布图为团N是28号元素,位于元素周期表的第四周期第Ⅷ族,Fe失去第三个电子后价电子变为3d,是半充满结构较稳定,Ni失去三个电子后价电子变为3d,较容易失去第四个电子,所以失去第四个电子所需的能量N小于Fe。(2)将左边结构补全会形成两个环,被两个环共用的氧原子左边有7个,右边有7个共14个,独立成个体的氧原子共有10个(上边有5个,下边有5个),同时每个环都有独立的硅原子,则N(Si):N(O)=(4+4×0.5):(14×0.5+10)=6:17,这样,每个环所包含的氧有17个,硅有6个,再根据Si+、O2-的化合价,其结构式的通式为(Si4O17)n0(3)①K与O间的最短距离为面对角线的一半,则K与O间的最短距离为×0.446nm≈0.315mm,与K紧邻的O在以K为顶点的正方形的面心,一个晶胞中距离顶点K最近的O有3个,顶点处的K被8个晶胞共有,面心O被2个晶胞共有,所以与K紧邻的O的个数为3×8×2=12。②根据钙钛矿CaT,O4的晶体结构分析Ca2+位于晶胞的体心,Ti位于晶胞的顶点,O2位于以Ti+为体心的正八面体的顶点,则一个晶胞中含有1个Ca2+、1个Ti+和3个O2-,则化学式为CaTO3,Ca2+和O2-之间的最短距离为apm,则晶胞参数为2apm.一个品胞相当于有一个CaTO3,根据密度公式可得40+48+16×NA(2√2a×10或40+48+16×3N、2√2a2×10-3NA162a2×10-80





